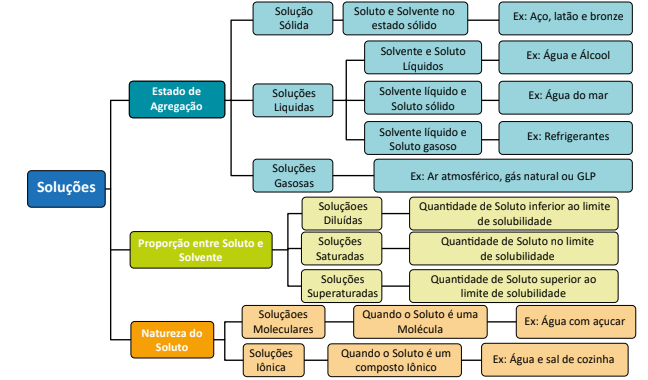
Soluções químicas são misturas homogêneas (aquelas que apresentam uma única fase) formadas pela união de diferentes substâncias, sendo que uma delas é o soluto e a outra o solvente, têm classificação em diferentes categorias e possui algumas fórmulas.
Nesse sentido, entender sobre soluções químicas, é preciso ter em mente alguns conceitos:
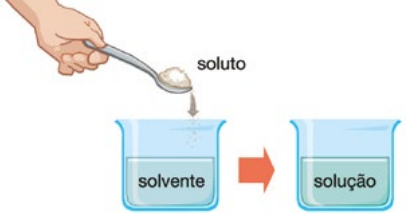
Soluto: É a substância que será dissolvida, normalmente está em menor quantidade.
Solvente: É a substância onde o soluto será dissolvido, geralmente está em maior quantidade.
Coeficiente de solubilidade: Grandeza que determina quantidade de máxima de soluto que pode ser dissolvida em uma determinada quantidade de solvente.
Classificação de soluções
A classificação de uma solução de acordo com alguns critérios, sendo:
- Quanto ao estado de agregação (sólido, líquido, gasoso);
- Quanto a natureza das partículas dispersas (iônicas, moleculares);
- Quanto a proporção entre soluto e solvente (diluída ou insaturada, concentrada ou
saturada).
A proporção entre soluto e solvente que faz com que uma solução fique forte (nome atribuído a uma solução que tem uma grande quantidade de soluto em relação à quantidade de solvente, chamada de solução concentrada); ou que uma solução fique fraca (quando a quantidade de soluto é pequena em relação à quantidade de solvente, chamada de solução diluída ou insaturada).
Dessa forma, quando uma solução possui o máximo de soluto, permitido pelo seu coeficiente de solubilidade, chamamos de solução saturada.
Ademais, a solução pode possuir uma quantidade de soluto maior que a estipulada pelo coeficiente de solubilidade a uma dada temperatura, e esta quantidade a mais fica precipitada no fundo do recipiente, chamamos de solução saturada com precipitado.
Fórmulas
Primeiramente, para sabermos a concentração em massa de uma solução, utilizamos a relação da massa em gramas de soluto dividido pelo volume da solução em Litros, sendo essa a primeira das fórmulas.
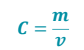
(Assim, a concentração de uma solução é igual a massa do soluto dividido pelo volume da solução)
Onde:
C: concentração de uma solução em gramas por Litro (g/L) m: massa em gramas (g)
V: volume da solução em Litros (L)
Nesse sentido, quando uma solução está muito concentrada e deseja-se diminuir a sua concentração, aumenta-se a quantidade de solvente, isso fará com que a massa da solução aumente mantendo a mesma massa de soluto. Assim, a esse processo atribui-se o nome de “diluição de soluções”.
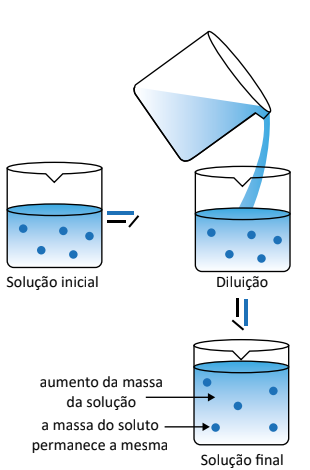
Quando se faz uma diluição, é possível calcular a nova concentração da solução ou até mesmo descobrir qual é o volume inicial ou final de uma solução em diferentes valores de concentrações. Assim, utiliza-se mais uma das fórmulas:
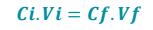
(Fórmula para calcular a concentração de uma solução após esta ser diluída)
Sendo:
Ci: Concentração inicial (g/L)
Vi: Volume inicial (L)
Cf: Concentração final (g/L)
Vf: Volume final (L)
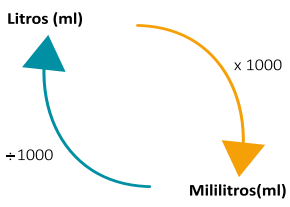
Caso o volume das soluções esteja em mililitros (mL), é necessário converter para litros (L). Dessa forma, faz-se essa conversão da seguinte forma:
Transformar o volume em mililitros (mL) para litros (L): divide o valor por 1000 (mil).
Transformar o valor em litros (L) para mililitros (mL): multiplica o valor por 1000 (mil).
Exemplo:
Ana está gripada e deseja preparar 1 L (litro) de chá, mas não quer que esse chá fique muito “forte”, com concentração aproximada de 8 g/L. Entretanto, ao preparar observou que esse exemplo de soluções ficou muito forte (concentração: 12 g/L) e por isso precisa diluir este chá.
Mas para chegar a uma concentração de 8 g/L, quanto ela deve acrescentar de água?
Resposta:
Ci.Vi = Cf.Vf
(Concentração inicial vezes volume inicial = concentração final vezes volume final)
12 × 1 = 8 × Vf
12 = 8 × Vf
Vf = 12
8
(A concentração final 8 que estava multiplicando passa dividindo)
Vf = 1, 5L
(Valor do volume final)
Desta forma, para que o chá fique com uma concentração de 8 g/L, é necessário acres-
centar 0,5 L (500mL), pois o volume final é 1,5L.
Mapa Mental Soluções Químicas